………………………………
بلشي بغسيل الملابس لو عباية غسلناها هل تتغير هذه لبملدة طبعا بتكوني بالبداية راجعتي تعريف وحالات المادة
واستخدمي الباوربوينت اللى نزلتوا الاخت عليا الزعابي كتير حلو وبتستفيدي منوا
………………………………
احم ممكن تقرير عن الخواص و التغيرات الكيميائية و الفيزيائية للصف العاشر ..
حتى لو عندكم مواقع ثانية تخص هالموضوع .. أكون شاكرة لكم ..
و مشكورين مقدماً 
شوفي هالموقع ان شاء الله تستفيدين منهـ ,, ^^
,.. http://www.jalaan.com/book/index.php ..,
والسموحهـ ع القصوٍر
^^
|
مشكورة أختي والله يعطيج العافية
|
[/COLOR]
لآآ هآأنج ـآلرب .. بس نبـآ موقع غيره لـآنه ـآلبحوث ـآللي فيه وـآيد مختصره -__-
ــآلثمووحه موحه منـج ختيـه .. ~
تقبلي تحيـآتيه :: خويتـج غلآآآ ـآلمحيربي
^_^
المقدمة :
من المهم جدا أن نعرف الفرق بين التغيرات الفيزيائية والتغيرات الكيميائية. فكلا النوعين من التغيرات يعتمد عليها دراسة التفاعلات الكيميائية وحالات المادة. كثيرا ما نتفق أن بعض التغيرات تكون واضحه, ولكن هناك بعض الأساسيات يجب أن نٌعتمدها.
العرض :
التغيرات الفيزيائية عبارة عن تغيرات في الطاقة والحالات المادة. بينما التغيرات الكيميائية تكون على مستوى التغيرات التي تحدث لمكوناتها الأساسية ( ذرات ، جزيئات .. ). فعند الضغط على علبة معدنية واعوجاجها, أكون قد أحدثت عليها تغيرات فيزيائية . حيث أن شكلها تغيير بينما حالتها لم تتغير. كما وأننا عندما نصهر مكعب ثلج فإننا أيضا نحدث تغيرات فيزيائية ( بإضافة طاقة ) . مثل هذه الأمثلة هي تغيرات في حالة المواد. فأنت تسبب تغيّرات فيزيائية إذا ما أثّرت بقوى مثل الحركة أو الحرارة أو الضغط.
أما التغييرات الكيميائية فإنها تحدث في مستوى أصغر. وقد تظهر بشكل واضح في التجارب عند تغير الألوان بالرغم من أن هذه التغيّرات قد حدثت لدقائق لا ترى. فمثلا عند ظهور صدأ الحديد الأحمر ( وهو عادة يلزمه فترة طويلة نسبيا للظهور) فهذا يعني أن ذرات الحديد الأصلية قد تغير تركيبها ( تأكسدت ). أما ذوبان مكعب السكر هو تغيّر فيزيائي لأن المادة ما زالت سكر . بينما لو حرقنا مكعب السكر يصبح التغير تغيّرا كيميائيا ، فالطاقة الحرارية ستعمل على كسر الروابط الكيميائية في السكر ولا يعد سكر.
إن التغيرات الكيميائية قد تكون صغيرة جدا أو أنها قد تحدث على عدة مراحل ويكون نتيجتها نفس عدد الذرات ، إنما يصبح لها تركيب مختلف. فمثلا من السكريات الآحادية : الجلوكوز والجلاكتوز والفركتوز وجميعها تمتلك 6 ذرات كربون و12ذرة هيدروجين و6 ذرات أكسجين. فبالرغم من تشابهها في عدد ونوعية الذرات، إلا أن لها أشكال مختلفه تسمى المتصاوغات. ولكل منها لها التفاعلات الكيميائية المختلفة بسبب اختلافها في الصيغة البنائية.
أمثلة على التغيرات الكيميائية :
التغيرات الكيمائية غير مقتصر حدوثها في المختبر الكيميائي. وسنعرض هنا بعض الأمثلة هذه التغيرات الكيميائية مع معادلتها الكيميائية :
• عادة ما تفقد الملعقة الفضية بريقها وذلك لتفاعلها مع الكبريت الذي في الهواء ليكوّن كبريتيد الفضة ذات اللون الأسود
2 Ag + S –> Ag2S
• عند تعرّض الحديد للهواء الجوي , فإنه يصدأ لتفاعله مع الأكسجين.
4 Fe + 3 O2—> 2 Fe2O3
• يحترق الميثان متحدا مع الأكسجين في الهواء لتكوين ثاني أكسيد الكربون وبخار الماء
CH4 + 2 O2 –> CO2 + 2 H2O
• مضاد الحموضة ( هيدروكسيد الكاليسيوم ) دواء يعادل حموضة المعدة ( حمض الهيدروكلوريك ).
Ca(OH)2 + 2 HCl–> CaCl2 + 2 H2O
• الجلوكوز ( سكر بسيط ) يتخمر إلى الإيثانول وثاني أكسيد الكربون. السكر الذي في العنب أو الحبوب يتخمر باستخدام الخميرة لصنع الكحول وثاني أكسيد الكربون. وثاني اكسيد الكربون هو الغاز الذي يتصاعد بكثرة في المسكرات
C6H12O6 (glucose)– 2 C2H5OH (ethyl alcohol) + 2 CO2
• الكحول مع الأكسجين يصبح خل مع جزيئات من الماء. هذا التفاعل أكثر تعقيدا من تخمّر الكحول بسبب التفاعلات الكيميائية الحيوية.
C2H5OH + O2 –> HC2H3O2 + H2O
وكقاعدة عامة، فالتفاعلات الكيمياحيوية تصبح أمثله ضعيفة لتوضيح التفاعلات الكيميائية الأساسية لأنها تفاعلات واقعية تحدث في أجسام الكائنات الحية وتحت سيطرة الأنزيمات .
أمثلة على التغيّرات الفيزيائية:
هنا بعض الأمثلة للتغيرات التي لا تعتبر كيميائية. ففي كل حالة يمكن للمواد الأصلية أن يعاد اصلاحهاوتعديلها بالعمليات الفيزيائية
• غليان الماء في غلاية الشاي أو تكاثفه على الزجاج البارد
• علبة من الألومنيوم توضع في على الغاز ويتم تسخينها
• تحوّل الثلج الجاف من المادة الصلبة إلى الحالة الغازية لتكوين غاز ثاني أكسيد الكربون ( التسامي )
• صهر الذهب أو تصلبه
• خلط الرمل مع الملح
• طحن قطعه من الطبشور إلى بودرة
• جعل قضيب من الحديد مغنطيسا
• اذابة قطعة السكر في الماء
المنطقة الرمادية ما بين التغيّرات الكيميائية والتغيّرات الفيزيائية :
يمكن القول بأن هناك منطقة رمادية نقف فيها ونتساءل .. هل هذه التغيرات هي كيميائية أم فيزيائية؟ ولماذا ؟
ذوبان ملح المائدة في الماء
تترابط الأيونات في المركبات الأيونية بروابط أيونية ،وعند تكوين المحلول تتأين مثل هذه المركبات – عادة – حيث يعمل جزئ الماء على إبعاد الأيونات عن بعضها البعض. وملح الطعام ( كلوريد الصوديوم ) مثال جيد للمادة الأيونية. معظم المواد الأيونية مثل كلوريد الصوديوم تكون على شكل بلورات صلبة تتأين في المحاليل المائية. فالكمية القليلة من ملح الطعام تذوب بسرعة كبيرة في قدر الطبخ لتتحول إلى أيونات
كيف لنا أن نعرف بأن الأيونات في المحلول ؟
مثل هذه المحاليل تتميّز بأنها موصلة جيدة للتيار الكهربائي بسبب حرية حركة أيوناتها :
NaCl –> Na+ + Cl-
تنجذب أيونات الصوديوم الموجبة نحو جانب ذرات الأكسجين السالبة في الماء وتتجه أيونات الكلوريد السالبة نحو جانب ذرات الهيدروجين الموجبة من جزيئات الماء.
في هذه الحقيقة الواقعة .. هل هو تفاعل أم لا ؟ نحن ذكرنا بأن التغييرات الفيزيائية هي الحالة التي لا يحدث أي تغيرات كيميائية للمتفاعلات أو المواد ألأصلية ويمكن إعادة تصليها بالعمليات الفيزيائية. وأن التغيّرات الكيميائية التي يتكون فيها مواد جديدة.
ويمكن الجزم هنا بأن كلوريد الصوديوم الصلب أكيد يختلف عن أيونات الصوديوم وأيونات الكلوريد. والأيونات توّصل التيار الكهربائي ويمكنه أن يتفاعل في التفاعلات الأيونية. لكن من جانب آخر , فمثل هذه الأيونات يمكن اعادتها تماما إلى المواد الأصلية بعملية تبخير الماء . ومثل هذا يتم عادة بتبخير ماء البحر للحصول على الأملاح.
هل تكسّرت الروابط؟ نعم , فإذا قمت بفصل أيونات الصوديوم اشعاعيا ونقلتها إلى محلول أيونات لم يتم فصلها . فروابط البلورة سيتم تشكيلها وستختلط الأيونات المفصولة مع الأيونات الغير مفصولة . فالبلورة كتلة متماسكة من الأيونات التي تأخذ الأماكن المنظمة ولا تعمل جزيئات منفصلة عن بعضها البعض .
بعض المركبات الأيونية مثل حمض الأستيك , يتأين جزئيا في الماء مكونا أيون الأسيتات وأيون الهيديوجين . حمض الأستيك حمض ضعيف , وهذا يعني بأن المادة لم تذوب كليا في الماء ، إلا أن هناك أدلة على وجود متميّز لأيونات الهيدروجين .
• تبلور كبريتات النحاس المائية الزرقاء بالحرارة
تتميّز كبريتات النحاس المائية بلونها الأزرق اللافت للنظر ولمعانه الزجاجي الظاهر لبلوراته . هو أحد البلورات المائية التي ترتبط معه جزيئات الماء مع الأجزاء الغير مائية منه لتكوّن بلورة شبكية. ويتم التعبير عنها بنقطه بعد الصيغة الجزيئية للمركب للتعبير من وجود الماء في الجزء الأيوني منه.
ومن المعروف عن البلورات المائية فالتسخين اللطيف سيفصل جزيئات الماء عن كبريتات النحاس. وخلال التسخين سيتحوّل لون الأزرق المبهر إلى مسحوق لونه أزرق باهت، لخروج الماء منه كبخار كما في المعادلة :
CuSO4.5H2O –> CuSO4 + 5H2O
ارتباط الماء بكبريتات النحاس يكون بنسبة 1 : 5 مول. وعملية فصل الماء عن البلورة لن يكون لمدة طويلة .. فبمجرد إضافة قطرة من الماء إلى البلورة المجففة فإنها تكون شرهه للماء وستلتقط الماء وهي تحدث صوتا لشدة التفاعل مصاحبا بالحرارة. وتغيّر في اللون مشابه للبلور المائية .
في هذه الواقعة هل هو تفاعل أم لا ؟ فتبادل الحرارة ، والنسبة الثابته ما بين الماء وكبريتات النحاس والتغيّر في الخصائص تجعل من النقاش متحيّزا لاعتباره تفاعلا. أما في الجانب الآخر ، كون أن الماء يظل ماء وصيغة كبريتات النحاس لا تتغير. والعملية قابلة للانعكاس بعملية فيزيائية بسيطة وهي إضافة القليل من الماء أو التسخين اللطيف لفصل الماء .
ملاحظة : كبريتات النحاس مادة سامة بسبب وجود أيونات النحاس. والنحاس والفلزات الثقيلة الأخرى مثل الرصاص والزئبق تسبب مشاكل في خلايا الكائنات الحية. تعتبر تجربة إزالة الماء من كبريتات النحاس المائية خطرة لأن استخدام بلورة كبيرة قد تنفجر بفعل الحرارة وتسبب تناثر كبريتات النحاس في كل مكان . كما وأن بودرة البلورة اللامائية أيضا خطرة
ورقة عمل بسيطة لتغيرات الكيميائية و الفيزيائية
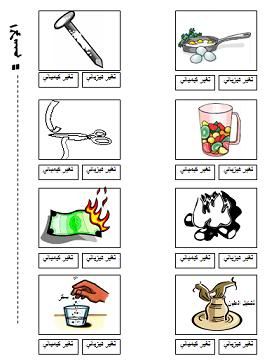
التحميل من الرابط أو من المرفقات
http://www.mediafire.com/?4d7lznzc74mmpqt
لا تنسونا من دعائكم الصالح و بالتوفيق لي بالدراسة و لوالدتي رحمها الله وغفر لها
| التغيرات الفيزيائة و الكيميائية.rar (145.2 كيلوبايت, المشاهدات 336) |
| التغيرات الفيزيائة و الكيميائية.rar (145.2 كيلوبايت, المشاهدات 336) |
| التغيرات الفيزيائة و الكيميائية.rar (145.2 كيلوبايت, المشاهدات 336) |
| التغيرات الفيزيائة و الكيميائية.rar (145.2 كيلوبايت, المشاهدات 336) |
| التغيرات الفيزيائة و الكيميائية.rar (145.2 كيلوبايت, المشاهدات 336) |
للرفع ليتزامن مع وقت الدرس
| التغيرات الفيزيائة و الكيميائية.rar (145.2 كيلوبايت, المشاهدات 336) |
جزاك الله خير
| التغيرات الفيزيائة و الكيميائية.rar (145.2 كيلوبايت, المشاهدات 336) |
| التغيرات الفيزيائة و الكيميائية.rar (145.2 كيلوبايت, المشاهدات 336) |
| التغيرات الفيزيائة و الكيميائية.rar (145.2 كيلوبايت, المشاهدات 336) |
| التغيرات الفيزيائة و الكيميائية.rar (145.2 كيلوبايت, المشاهدات 336) |
| التغيرات الفيزيائة و الكيميائية.rar (145.2 كيلوبايت, المشاهدات 336) |
استلام الصور لدى مدرسة الابداع للتعليم الثانوي
انظر المرفق
| مسابقة 1الفيزياء 2022م.doc (42.5 كيلوبايت, المشاهدات 18) |
دلموك
| مسابقة 1الفيزياء 2022م.doc (42.5 كيلوبايت, المشاهدات 18) |
| التغيرات الفيزيائية.doc (28.5 كيلوبايت, المشاهدات 985) |
| التغيرات الفيزيائية.doc (28.5 كيلوبايت, المشاهدات 985) |
| التغيرات الفيزيائية.doc (28.5 كيلوبايت, المشاهدات 985) |
مجهود طيب لكن ينقصها التنسيق ..’
..’
بالتوفيج ..’
| التغيرات الفيزيائية.doc (28.5 كيلوبايت, المشاهدات 985) |
| التغيرات الفيزيائية.doc (28.5 كيلوبايت, المشاهدات 985) |
| التغيرات الفيزيائية.doc (28.5 كيلوبايت, المشاهدات 985) |
رايي أن الأسئلة رائعة ولكن تنقصها بعض الصور..
أتخيلها بتكون أحلى…
الله يعطيج ألف عافية…
| التغيرات الفيزيائية.doc (28.5 كيلوبايت, المشاهدات 985) |
| التغيرات الفيزيائية.doc (28.5 كيلوبايت, المشاهدات 985) |
| التغيرات الفيزيائية.doc (28.5 كيلوبايت, المشاهدات 985) |
| التغيرات الفيزيائية.doc (28.5 كيلوبايت, المشاهدات 985) |
| التغيرات الفيزيائية.doc (28.5 كيلوبايت, المشاهدات 985) |
| التغيرات الفيزيائية.doc (28.5 كيلوبايت, المشاهدات 985) |
رتب أية تجربة تريد أن تكتب تقريرها العلمي كما يلي :
1.اسم التجربة.
2.الغاية(الهدف) من التجربة ماذا نريد قياسه في هذه التجربة.
3.القانون الفيزيائي و عرف رموزه و أذكر واحداته.
4.الأجهزة المستخدمة في التجربة مع ذكر مجال القياس الملائم للتجربة.
5.رسمة الدارة أو الشكل التوضيحي للتجربة.
6.خطوات العمل خطوات إجراء التجربة.
7.جدول النتائج (رتب النتائج في جدول كي تستطيع الاستنتاج منها).
8.الرسم البياني (اذا وجد).
9.الحسابات مثل الميل أو الثوابت الموجودة في القانون الفيزيائي الذي تقوم عليه التجربة.
10.المناقشة.
11.الإجابة على الأسئلة الموجودة في نهاية التجربة إن وجدت.


 اي مما يلي ليس من خصائص المعدن؟) الجواب :يتكون في المختبر. السؤال الثالث
اي مما يلي ليس من خصائص المعدن؟) الجواب :يتكون في المختبر. السؤال الثالث  اصغر جزء في العنصر يحمل كل خصائصه.) الجواب
اصغر جزء في العنصر يحمل كل خصائصه.) الجواب  الذرة)(ب) السؤال الرابع
الذرة)(ب) السؤال الرابع  مادة لايمكن تجزئتها الى مواد ابسط بوسائل كيميائية) الجواب
مادة لايمكن تجزئتها الى مواد ابسط بوسائل كيميائية) الجواب  العنصر) (ج).
العنصر) (ج). شكراااااااا كثيييييييييييييييير
 مينه
مينه
ورقة عمل
الاسم : ………………. الصف والشعبة :…………………….
1- عدد خصائصتا فيزيائية ؟…………………………………………. …………………………………
2- ما هي الخاصية الفيزيائية ؟…………………………………………. ……………………………..
3- ما هي الكثافة ؟…………………………………………. …………………………………………..
ماهو ا لتغير الفيزيائي ؟…………………………………………. ……………………………………..
اين تجد السائل اقل ؟…………………………………………. …………………………………………
ماذا يحصل لجسم صلب مصنوع من مادة كثافتها أكبر من اكثر كثافة الماء عندما نضعة في الماء؟
………………………………………….. ………………………………………….. ……………….